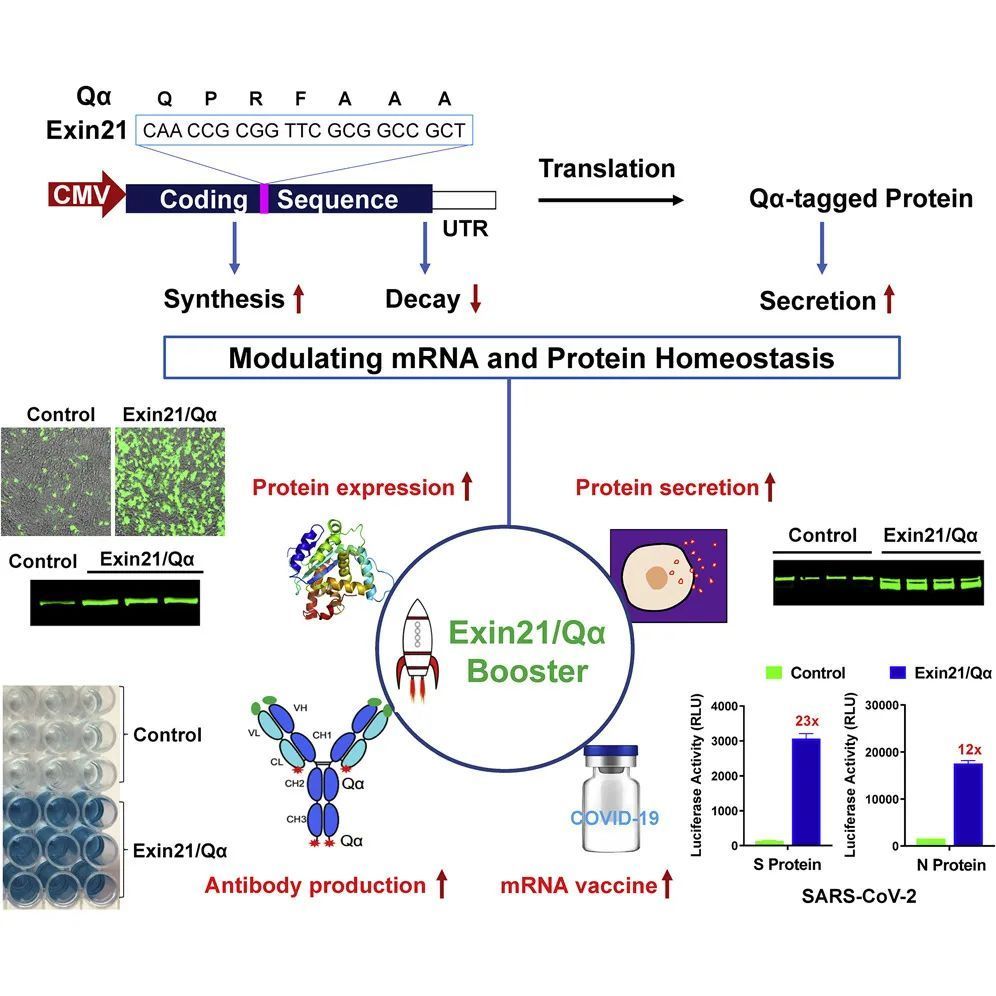
在生物技術領域,mRNA(信使核糖核酸)療法作為一種革命性的治療手段,展現出巨大的潛力,特別是在疫苗開發、癌癥治療和遺傳性疾病糾正方面。mRNA分子的不穩定性以及在細胞內的低效表達,一直是制約其廣泛應用的關鍵障礙。胡文輝教授及其團隊在生物制品技術開發領域取得重要突破,成功開發出一項能夠顯著穩定mRNA結構并高效促進其表達的新技術,為mRNA及基于其編碼的蛋白質療法帶來了新的曙光。
該技術的核心在于對mRNA分子進行精密的化學修飾與遞送系統的創新。傳統上,裸露的mRNA極易被細胞外的核糖核酸酶降解,且在進入細胞后,其翻譯效率也受到多種因素限制。胡文輝團隊的研究聚焦于兩個方面:一是通過引入新型的核苷酸類似物和優化序列結構,增強了mRNA本身對酶降解的抵抗力,延長了其在生物體內的半衰期;二是設計了一種新型的脂質納米顆粒(LNP)遞送載體,這種載體不僅能夠高效保護mRNA免受免疫系統攻擊和降解,還能更精準地將mRNA遞送到目標細胞內,并促進其從內體逃逸,從而大幅提升蛋白質的翻譯效率。
實驗數據顯示,應用該技術處理的mRNA,其穩定性比常規mRNA提高了數倍,在模型動物體內的蛋白表達水平也顯著增加,且未引起明顯的免疫副作用。這意味著,在更低的劑量下即可達到預期的治療效果,不僅提高了療法的安全性,也降低了生產成本。這項突破對于開發針對傳染性疾病(如流感、HIV)的mRNA疫苗,以及治療癌癥(通過表達腫瘤抗原或免疫調節因子)和罕見遺傳病(通過表達功能正常的蛋白質)的療法,具有極其重要的價值。
胡文輝團隊的技術創新,正處于生物制品研發從實驗室走向臨床轉化的關鍵節點。它為解決mRNA療法面臨的穩定性差、遞送效率低、潛在免疫原性等核心挑戰提供了切實可行的方案。隨著該技術的進一步優化和臨床試驗的推進,有望加速下一代mRNA藥物和蛋白質療法的上市進程,為全球公共衛生和精準醫療注入強大動力,標志著我們在利用遺傳信息直接編程細胞功能、治療疾病的道路上又邁出了堅實的一步。